VALIDATION
밸리데이션의 정의 및 목표
특정한 공정(Process), 방법(Method), 기계/설비(Equipment/Facility), 혹은 시스템(System)이
설정된 규격과 품질 요소들을 만족함을 보증하기 위한 증거를 문서화 하는 것으로서 바이오/제약 업계에서 주로 통용되는 개념.
공산품과 달리 의약품은 투여 후 부작용 발생 時 대체 불가능.
(최종 생산품에서 샘플 체취로 불량 유무를 확인 불가하며 이로 인하여 불량 발생 時 사람의 목숨을 담보로 해야 함.)
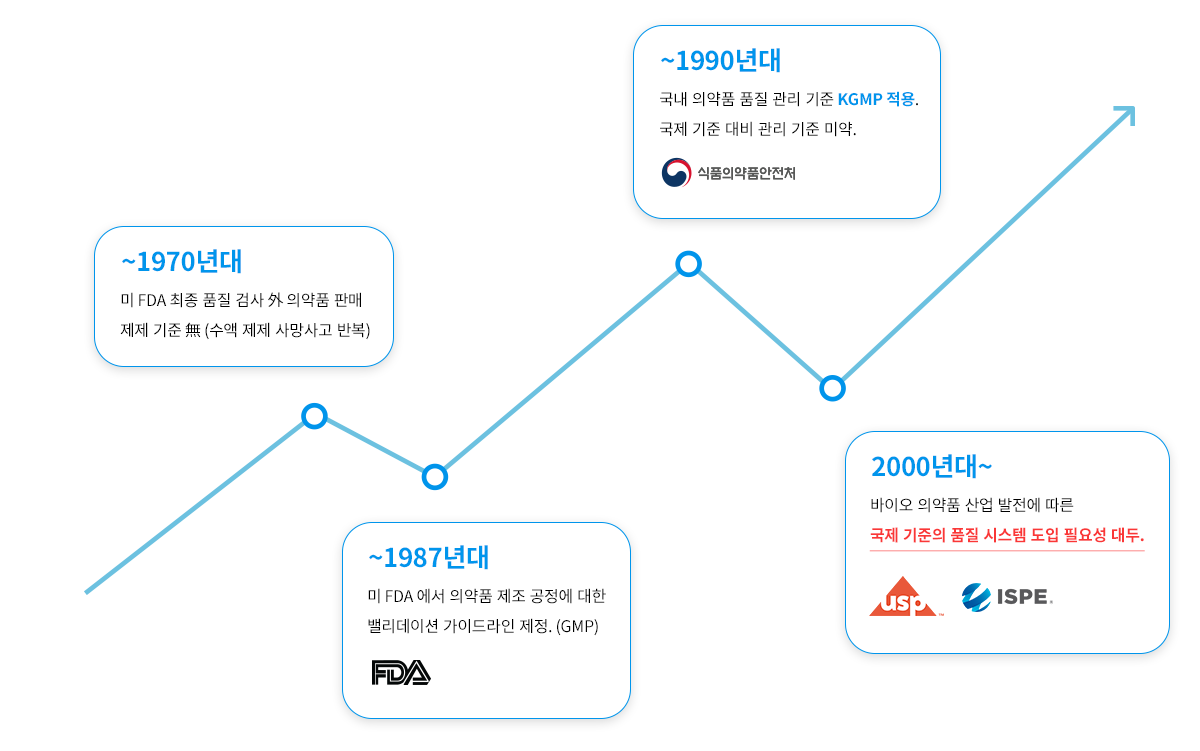
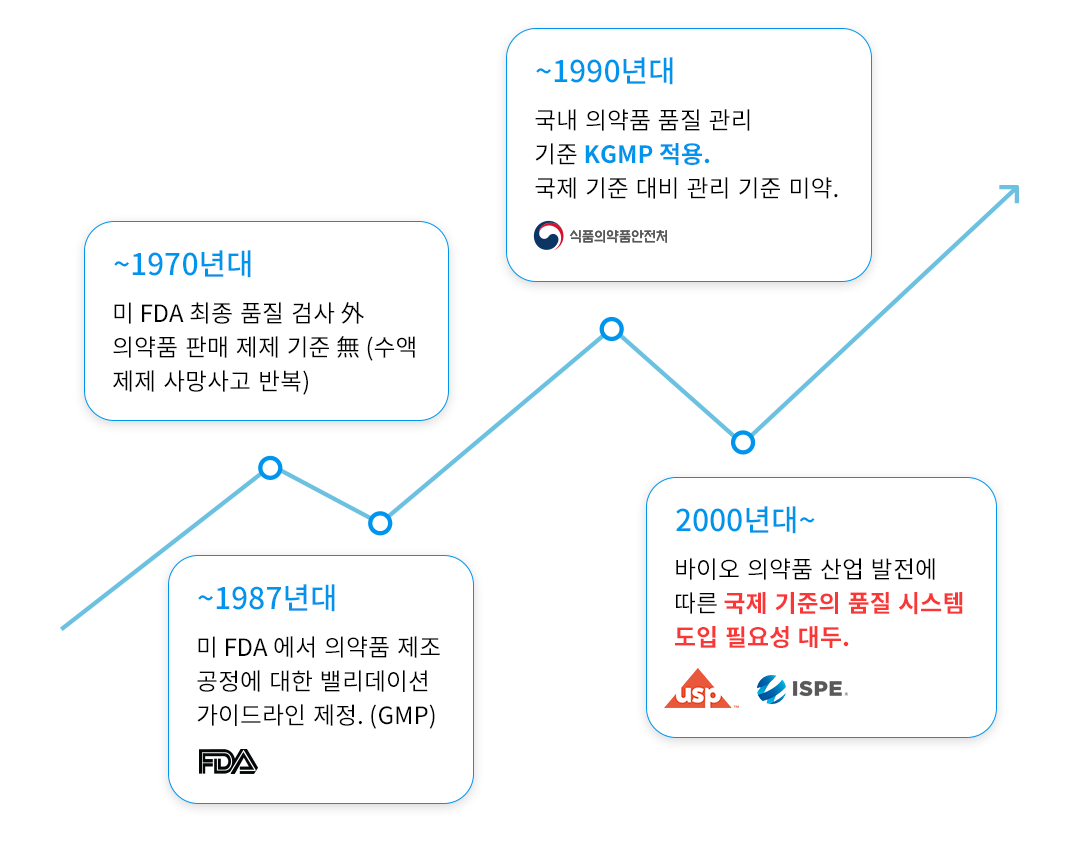
밸리데이션 발전 과정
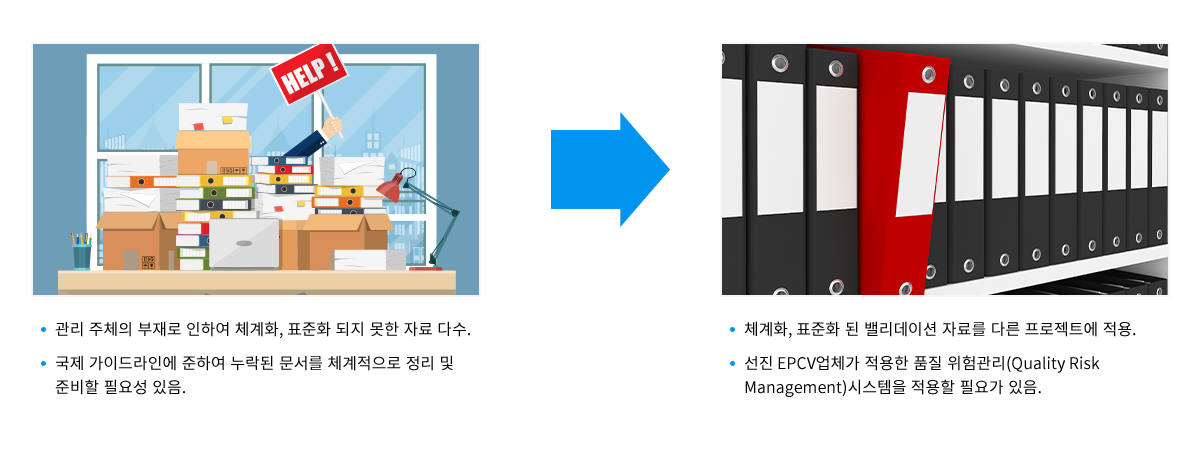
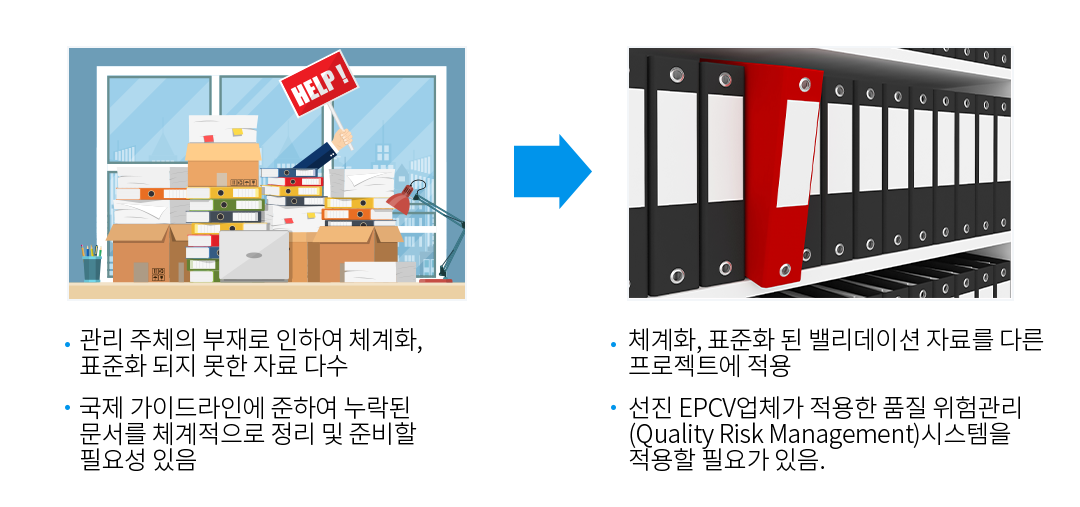
프로젝트 수행 시 생성된 자료들의 체계화, 표준화
- ※ 참조 필요한 국제 가이드 라인
-
- ASTM E2500, Standard Guide for Specification, Design, and Verification of Phamaceutical and Biopharmaceutical
Manufacturing Systems and Equipment - ICH Q9 Quality Risk Management / ICH Q10 Pharmaceutical Quality System
- ISPE Baseline® Pharmaceutical Engineering Guides for New and Renovated Facilities, Volume 5: Commissioning and Qualification
- PIC/S Validation Master Plan, Installation and Operational Qualification, Non-sterile Process Validation, Cleaning Validation
- 7.1.11 GAMP 5 Guide: A Risk-Based Approach to Compliant GxP Computerized Systems
- ASTM E2500, Standard Guide for Specification, Design, and Verification of Phamaceutical and Biopharmaceutical
설계 기반 품질 고도화 [Quality by Design]
- 과학적 접근법(Scientific Approach)과 품질 위험 관리(Quality Risk Management)에 근거하여 제품 및 공정에 대한 이해와 공정 관리를 강조하는 체계적인 접근법
- Facility 설계 초기부터 Good Engineering Practice (GEP) 적용을 통한 밸리데이션 준비


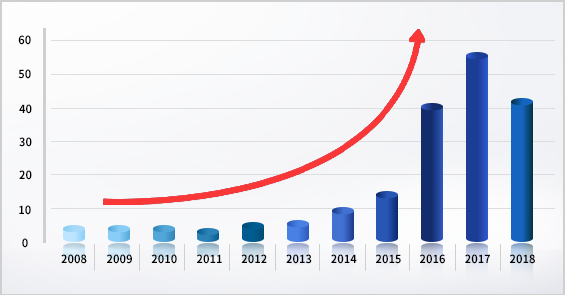
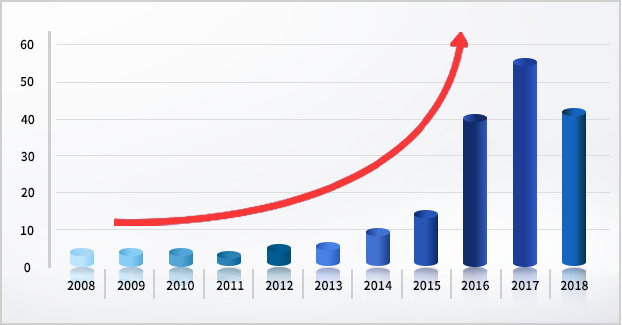
데이터 무결성 [Data Integrity]
- 컴퓨터 시스템이 적용되는 바이오/제약 장비 혹은 시스템에 대해서 수명주기 동안 데이터의 정확성, 일관성을 유지하고 보증하는 것.
- Attributable (출처), Legible (가독성), Contemporaneous (동시성), Original (원본), Accurate (정확성). ALCOA 원칙 적용 필수
- 2008년 이후 11년간 데이터 무결성 관련 Warning Letter 건 수는 급격한 증가 추세에 있음
- 최근 제약사에 대한 규제 기관의 Audit 실 주요 점검 포인트로 대두되고 있음
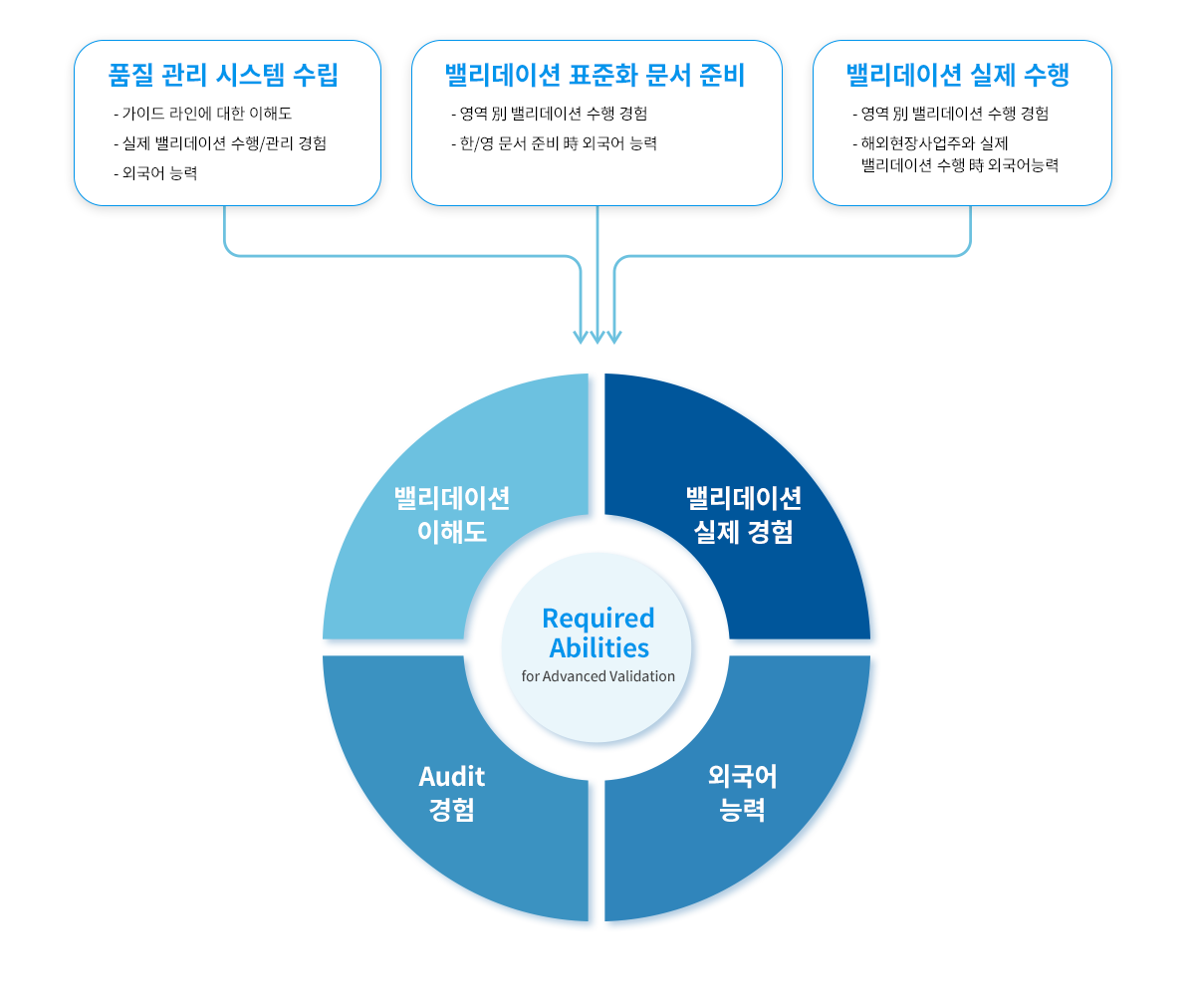
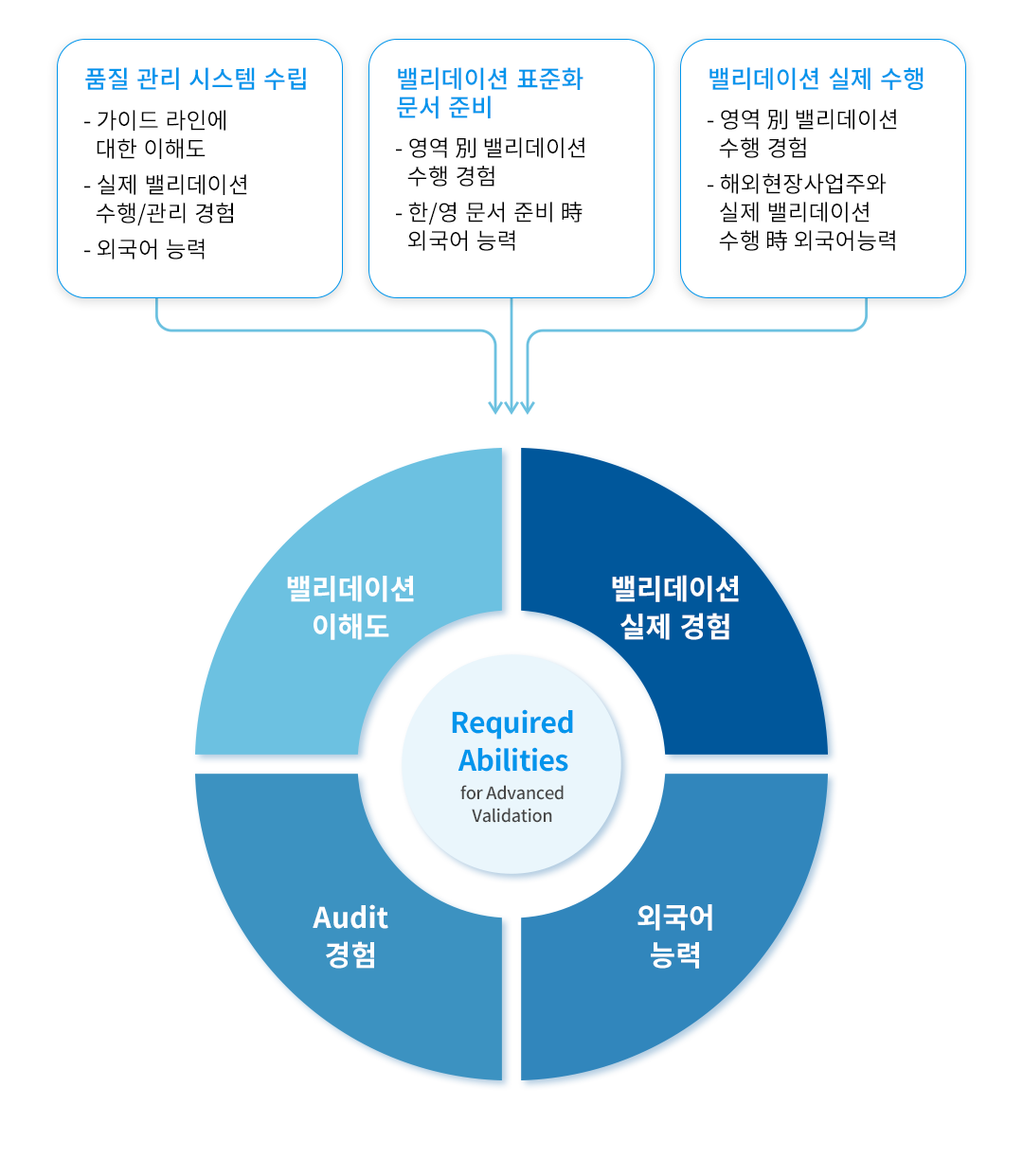
KBE Capabilities